448次
448次
 2023-07-28
2023-07-28
消毒剂稳定性评价可评估消毒剂经规定条件存放后能继续有效使用的能力。《消毒剂稳定性评价方法》(GB/T 38499-2020)规定了消毒剂保存稳定性评价的基本要求、试验分类、检测与评价要求和方法。该标准适用于对各类消毒剂保存稳定性的评价。该标准不适用于消毒剂开瓶后或活化后的保存稳定性评价。

作为第三方检测中心,中科检测机构拥有CMA认证检测资质,检测设备齐全,数据科学可靠,可出具国家认可的消毒剂稳定性评价报告。
消毒剂稳定性试验分类
稳定性试验按存放条件分为加速试验、长期试验和强光照射试验。
1)可使用加速试验初步确定产品有效期,作为上市销售的依据。
2)长期试验结果作为消毒剂实际有效期的最终依据,如产品通过了加速试验,但未通过相应的长期试验,应按实际长期试验的结果确定有效期;如产品未通过加速试验,但通过了相应的长期试验,按长期试验测定结果确定有效期。
3)采样新原料作为消毒剂有效成分的,应进行强光照射试验,由该试验证明为对光不稳定的消毒剂应采用避光包装。
消毒剂稳定性试验方法
1、加速试验
1)存放方法
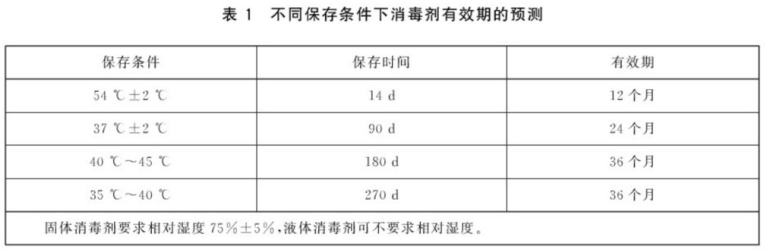
不同保存条件下消毒剂有效期的预测见表1。
2)检测方法
按化学法分别测定存放前、后消毒剂有效成分含量,或按微生物法分别测定存放前、后消毒剂杀灭微生物能力。
3)评价方法
a)有效成分含量或杀灭微生物能力符合要求时,按表1初步确定产品有效期。
b)在加速试验条件下,消毒剂的有效成分含量不符合要求或杀灭微生物能力不符合要求时,该消毒剂的有效期暂不作确定,应按长期试验的方法进行试验,以确定有效期。
2、长期试验
1)存放方法
将待测样品置温度25 ℃±2℃,相对湿度(60±10)%或温度30 ℃±2℃,相对湿度65%±5%恒温恒湿箱内或说明书标注的保存条件下,存放12个月(对溶液或混悬液等液体消毒剂可不要求相对湿度)。
12个月后仍需继续观察者,可存放至观察结束。采用温度25℃±2℃或30 ℃±2℃存放条件,由企业自己决定,如采用25 ℃±2℃存放条件,应在产品标签和说明书上加注“避免高温"或“于阴凉处保存”等说明性文字。
2)检测方法
分别于存放前和存放后第3、6、9和第12个月,按化学法分别测定存放前、后消毒剂有效成分含量,7.2.2检测方法
分别于存放前和存放后第3,6、9和第12个月,按化学法分别测定存放前、后消毒剂有效成分含量,或按微生物法分别测定存放前、后消毒剂杀灭微生物能力。
如于12个月后仍需继续观察时,分别于存放至第18和24个月及以后每隔12个月取样进行检测,直至有效成分含量或杀灭微生物能力低于相关标准要求。
3)评价方法
以有效成分含量符合要求或杀灭微生物能力符合要求的最长存放时间确定消毒剂的有效期。
3、强光照射试验
1)存放方法
分别将3个批次待测固体样品或其原料置于敞口培养皿中,厚度≤5 mm,对液体待测样品置于250 ml的无色透明磨口瓶内,装量宜为磨口瓶容量的80%,将盖子盖紧,然后放置于强光照试验箱中,在照度为4 500 lx±500 lx,温度为25 ℃±2 ℃,相对湿度为(60±10)%的条件下存放10 d。
2)检测方法
按化学法分别测定存放前、后消毒剂有效成分含量,或按微生物法分别测定存放前、后消毒剂杀灭微生物能力。
3)评价方法
经强光照射后,有效成分含量不符合要求或杀灭微生物能力不符合要求时,为光不稳定消毒剂。
4)化学法
a)可按照《消毒技术规范》(2002年版)中2.2等方法测定各种消毒剂有效成分含量。
b)每批次待测样品各测1份样品,每份样品重复测⒉次,取其平均值作为该批次样品有效成分含量。按式计算3个批次待测样品批间相对平均偏差。若批间相对平均偏差≤5%,取3个批次的平均值作为判定依据;若批间相对平均偏差>5%,则以平均偏差最大者作为判定依据。
5)微生物法
a)将按规定方法存放的3个批次待测样品等量混合后取样,按《消毒技术规范》2002年版)中2.1的方法检测各种消毒剂杀灭微生物能力。
b)在杀灭微生物试验中,所用指标微生物应为使用说明书中拟杀灭微生物中抗力最强者。
c)对只使用原液进行消毒的消毒剂,存放后,仍用消毒剂原液进行杀灭微生物试验;对稀释后进行消毒的消毒剂进行杀灭微生物试验,存放前后的稀释倍数应相同。
d)存放后杀灭微生物试验的作用时间及其他试验条件均应与存放前杀灭微生物试验相同。

检验检测认证服务机构。

整体技术解决方案。